Моделирование экологических проблем и способов их решений на уроках химии
Все изменения в окружающей среде при действии кислотных оксидов представлены в динамической части схемы 1.
Элементы динамической части схемы изображают на плотной бумаге и прикрепляют к статической части схемы 1 с помощью булавок по мере объяснения материала.
До начала объяснения воздействия кислотных осадков на различные среды обитания организмов на статической части схемы 1 прикрепляют следующие условные изображения: фито- и зоопланктон, моллюск, водоросли и значение
рН = 7,5 – возле водоема; бактерии-сапрофиты – в почве, слева от изображения водоема; азотфиксирующие бактерии – около корней клевера; здоровое хвойное дерево – справа от автомобиля.
Объяснение материала необходимо начать с рассмотрения антропогенных источников кислотообразующих выбросов, прикрепляя к башням ТЭС и трубам металлургического завода аппликации с изображением дымовых выбросов SO2 и NO2, а к выхлопной трубе автомобиля – изображение NOx, показывающее дымовое выделение оксидов азота (NО2 и NО).
После попадания оксидов серы и азота в атмосферу необходимо рассмотреть процессы, приводящие к образованию кислотных осадков.
Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот. Частично диоксид серы в результате фотохимического окисления превращается в оксид серы(VI) (серный ангидрид) SО3:
![]()
который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты:
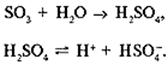
Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SO2•nH2O, который часто называют сернистой кислотой Н2SO3:
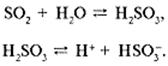
Сернистая кислота во влажном воздухе постепенно окисляется до серной:
![]()
Аэрозоли серной и сернистой кислот конденсируются в водяном паре атмосферы и становятся причиной кислотных осадков. Они составляют около 2/3 кислотных осадков. Остальное приходится на долю аэрозолей азотной и азотистой кислот, образующихся при взаимодействии диоксида азота с водяным паром атмосферы:

Методика проведения данной части урока может быть различной: объяснение и составление уравнений учителем, дописывание правых или левых частей уравнений учащимися или самостоятельное написание уравнений превращений кислотных оксидов в атмосфере.
Работа со схемой 1 выражается сначала появлением (на статической ее части) облака с уравнениями реакций, а затем – облака с формулой иона водорода. В схему вносят и различные виды осадков: дождевые капли или снежинки, на которых написан ион водорода (Н+). Это показывает, что в атмосфере произошли химические превращения, которые привели к выпадению кислотных осадков.
Далее логично рассмотреть изменения в окружающей среде, которые происходят под действием кислотных осадков. Начать это объяснение можно с любой среды обитания.
Средним значением показателя кислотности большинства почвенных вод, питающих реки и грунтовые воды, является рН около 8 [3]. Например, концентрация водородных ионов в озере Байкал соответствует пределам 7,0–8,5. В летнее время щелочность байкальской воды несколько увеличивается и рН возрастает до 8,0–8,5. Зимой рН близок к 7,0. С глубиной рН снижается, вода приобретает слабокислый характер [4].
